-
化学镀是一种新型的金属表面处理工艺,同电镀工艺相比,反应过程不需外部电源,具有镀层均匀、孔隙率低、耐腐蚀和耐磨性良好、节能等优势,近年来广泛应用于电子、机械、航天等许多领域[1-2]。然而,化学镀废液具有污染物浓度高、成分复杂以及处理难度大等特点[3-4],若排放到环境中会对环境造成极大危害,所以它的无害化处理已成为近年来环境领域的研究热点。
化学镀镍是化学镀领域应用最广的工艺,其化学原理为利用还原剂将离子形态的镍还原为单质镍并沉淀到基体表面。目前,常用次磷酸钠作为还原剂[5],因此,化学镀镍废液中主要的污染物质是磷和重金属镍。化学镀镍废液中的磷主要为残留的次磷酸根和反应产生的亚磷酸根,部分磷会以磷酸根的形式存在。溶液中的磷酸根通常可用氢氧化钙沉淀的方式去除[6],但次磷酸根和亚磷酸根却不易被去除。去除重金属离子的处理方法包括化学沉淀、电解法、离子交换法、反渗透、吸附法等[7-12],根据重金属离子存在状态与浓度的差异,可选择采用不同的处理方法。游离态重金属一般可通过加入氢氧化钠、碳酸钠等药剂,通过沉淀的方法直接去除,处理难度较低[13]。然而,由于化学镀镍过程中通常须添加柠檬酸钠等络合剂,使得化学镀镍废液中的镍离子通常以稳定的络合态存在[14],因此,一般的加碱沉淀法不能对其进行有效的去除[15]。
针对化学镀镍废水中2类主要污染物处理难度高且达标困难的问题,本研究采用H2O2氧化、芬顿氧化、铁碳处理、次氯酸钙氧化4种方法进行实验研究,探究各类方法对化学镀废水中磷、镍的同步去除效果,以寻找高效的去除路径,为实现化学镀镍废水中同步除磷去镍的目标提供参考。
全文HTML
-
研究中的化学镀镍废水为取自某电镀园区化学镀镍车间的生产废水,废水水质如下:COD 172 mg·L−1、TP 138.5 mg·L−1、Ni 81.4mg·L−1、NH3-N 242 mg·L−1、pH=8。
-
总磷的测定采用钼酸铵分光光度法(GB 11893-1989);镍采用火焰原子吸收分光光度法(GB 11812-1989);pH采用玻璃电极法。
-
利用强氧化剂将水中各种形态的含磷化合物转化为正磷酸根,再通过化学沉淀法形成难溶的Ca3(PO4)2(Ksp=2.0×10−29),将磷从水中去除。
利用强氧化剂破除水中络合物,将络合态镍转变为离子态,再通过调节系统pH,形成难溶的Ni(OH)2(Ksp=5.48×10−16),将水中金属镍去除。
-
用硫酸调节原水pH=3,投加一定量的H2O2(30%),在20 °C下搅拌反应1 h,Ca(OH)2调节pH>12,过滤。
用硫酸调节原水pH=3,投加4.8 g·L−1的FeSO4·7H2O和一定量的H2O2(30%),在20 °C下搅拌反应1~2 h,Ca(OH)2调节pH>12,过滤。
投加一定量的Ca(ClO)2,用硫酸调节反应初始pH,在一定温度下搅拌,反应一定时间,测定反应结束pH,使用Ca(OH)2,使体系pH>12,过滤。
在上述各实验方法中,各试剂投加量均以初始化学镀镍废水量为基准。
经实验测定,各方法均可有效去除废水中COD,使COD在50 mg·L−1以下,满足国家《电镀污染物排放标准》(GB 21900-2008)中的COD的要求限值。
用硫酸调节原水pH=4,投加一定量的H2O2(30%)和铁碳烧结固体(铁精粉≥70%,精焦煤≥20%),铁碳与废水体积比为1∶4,在20 °C下浸泡一定时间,过滤。
-
研究中采用的化学试剂主要包括30%过氧化氢(上海凌峰,分析纯)、七水合硫酸亚铁(国药沪试,分析纯)、次氯酸钙(麦克林,化学纯)、硫酸(国药沪试,分析纯)和氢氧化钙(上海凌峰,分析纯)。
1.1. 实验水样
1.2. 分析方法
1.3. 实验原理
1.4. 实验方法
1.5. 实验试剂
-
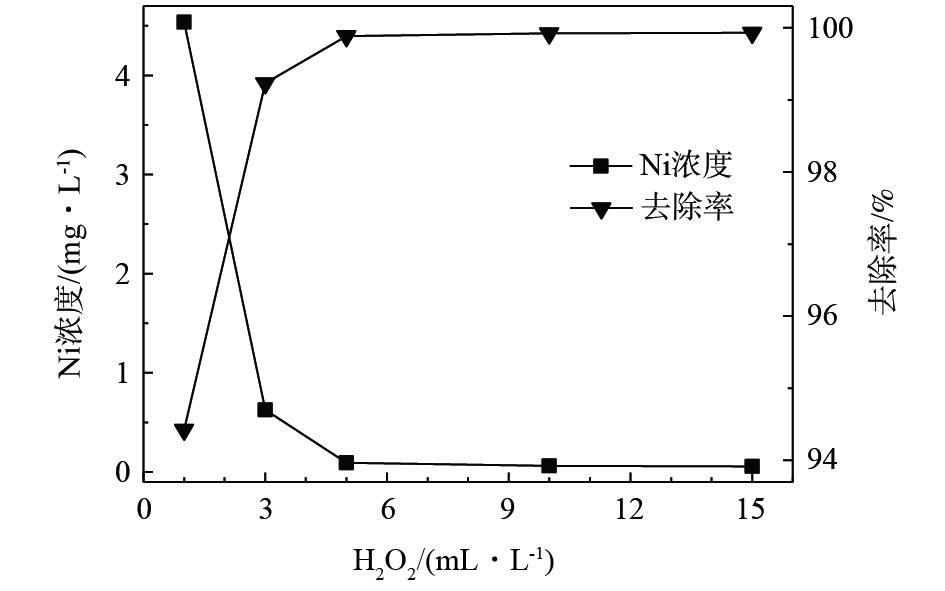
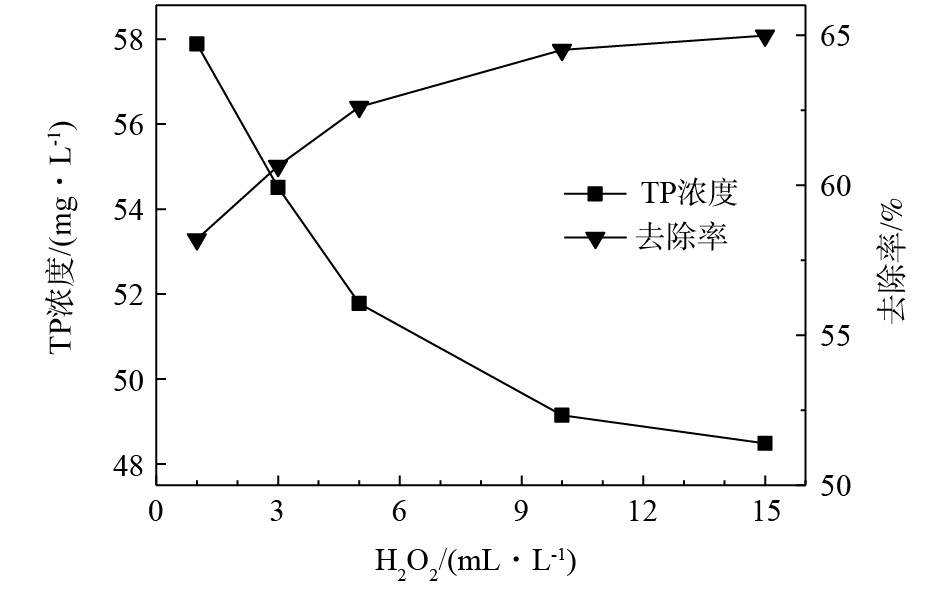
在酸性条件下(pH=3),选取反应温度为20 °C,当反应时间为1 h时,H2O2投加量对磷、镍处理效果的影响如图1和图2所示。随着药剂投加量的增加,水中剩余的磷、镍含量均相应下降。可以看出,H2O2作为氧化剂,可破坏水中络合物的结构,将络合态镍转化为游离态镍离子,进而通过沉淀的方式去除,同时,可将部分次磷酸根和亚磷酸根氧化为正磷酸盐。H2O2可实现镍的有效去除,当投加量为5 mL·L−1时,剩余镍含量低于0.1 mg·L−1,满足排放标准。H2O2投加量的增加可降低总磷含量,但下降速率逐步减缓,最终基本稳定在49 mg·L−1。对体系进行加热,去除效果也未有提升。可见,即使在酸性条件下,H2O2仍不能实现对总磷的有效去除。推测原因为,H2O2自身的氧化能力不能实现大量次磷酸根和亚磷酸根的全部氧化过程,且未在过程中有效产生自由基,导致氧化过程不能顺利进行。
-
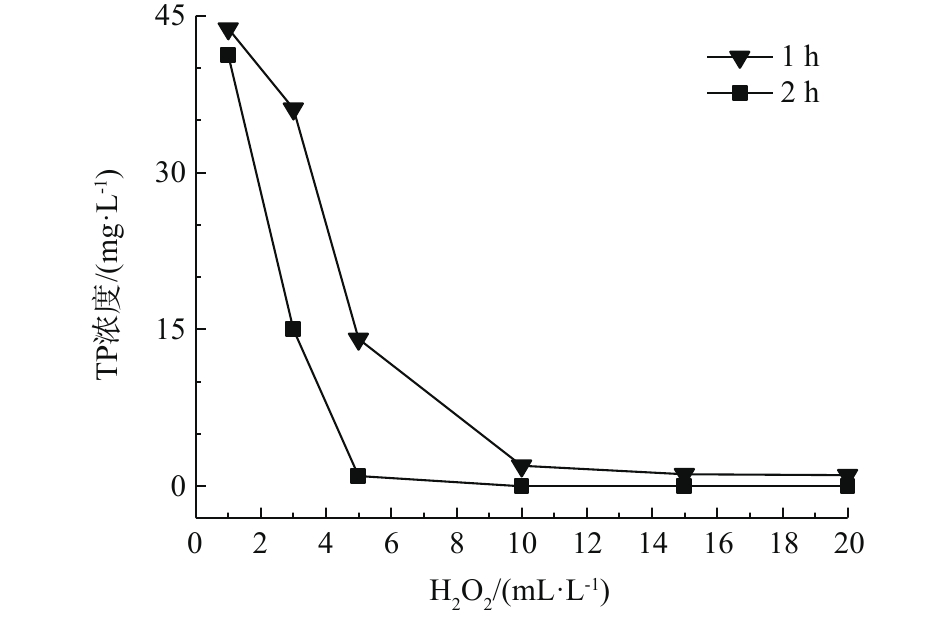
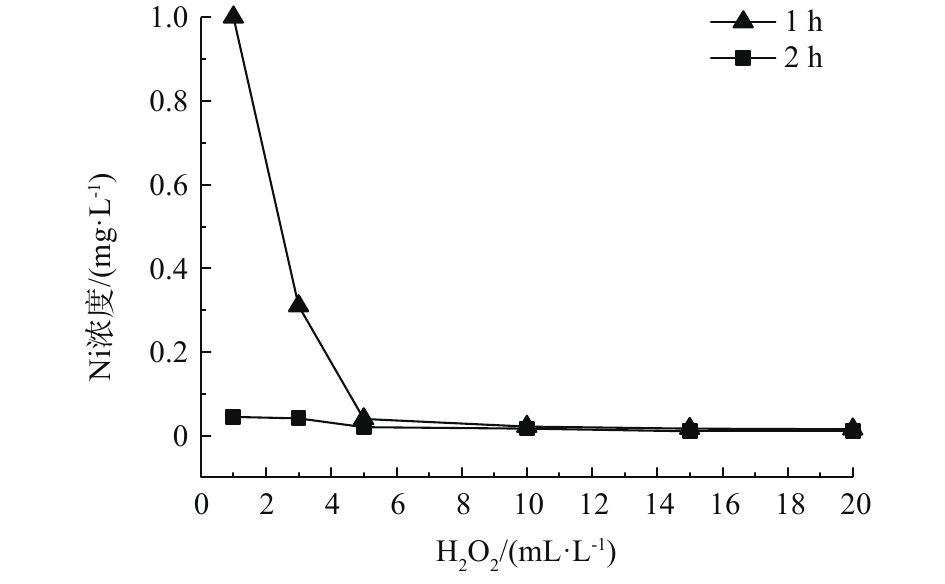
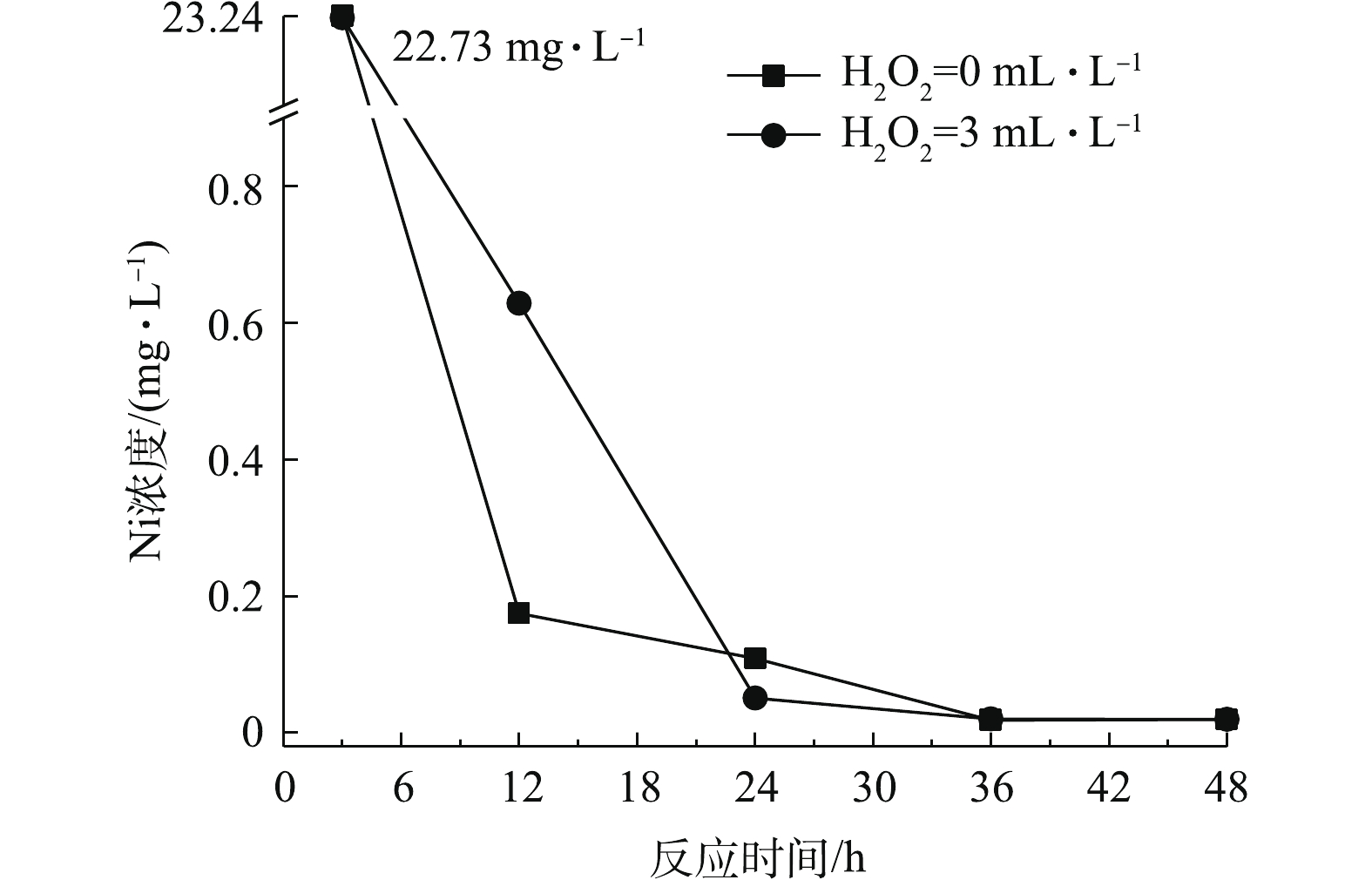
图3和图4分别为芬顿氧化对化学镀镍废液中总磷、镍的去除效果随H2O2投加量的变化情况。可以看出,在适宜条件下,芬顿氧化对总磷、镍均具有良好的去除效果。其去除原理为芬顿反应中产生的·OH具有极强的氧化能力,可有效破坏水中的络合物,释放镍离子;同时可与次磷酸根和亚磷酸根反应,将其氧化为正磷酸根。且去除效果与H2O2的投加量、反应时间成正比。当H2O2投加量大于3 mL·L−1时,增加投加量或增加反应时间均可促进氧化还原反应的发生,使废水中磷含量低于0.5 mg·L−1,镍含量低于0.1 mg·L−1,均达到国家排放标准。投加量不少于10 mL·L−1,反应时间不少于2 h时,可将废水中的总磷含量降低至0.5 mg·L−1以下;投加量不少于5 mL·L−1,反应时间不少于1 h时,可将废水中的镍含量降低至0.1 mg·L−1以下。在芬顿体系中,相较金属镍,总磷的去除需要更多的投药量或反应时间,因此,总磷的去除是同步除磷去镍的关键步骤。与H2O2氧化方法相比,芬顿工艺可达到同步除磷去镍的目的,并在去除速率、去除效果方面存在显著优势,特别是在总磷的去除方面,优势更加明显。
-
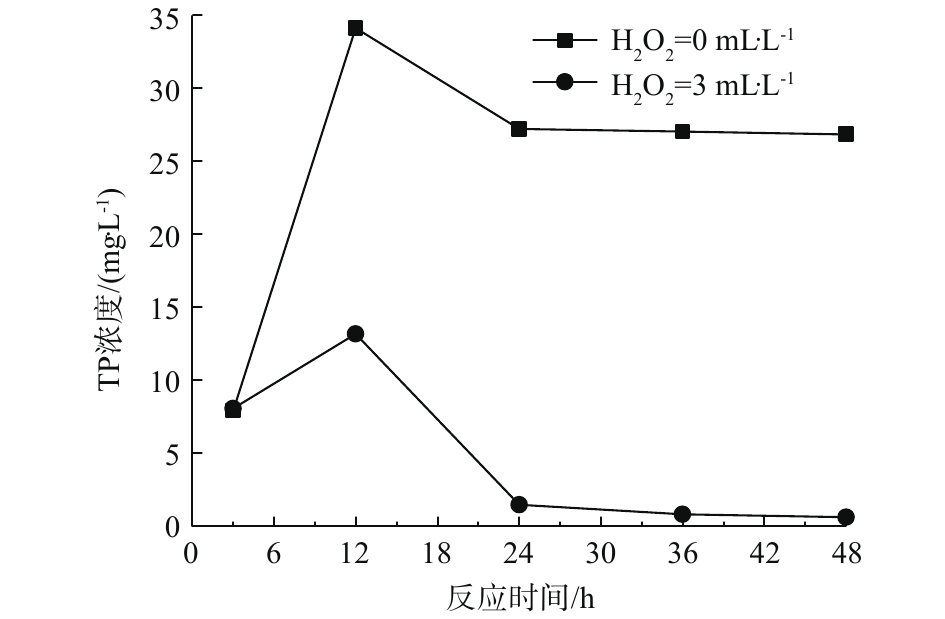
图5反映了总磷含量变化与铁碳处理中H2O2投加量和反应时间之间的关系。随着浸泡时间的延长,水中总磷含量先下降,后上升,再逐步下降并趋于稳定。在浸泡时间为3 h时,H2O2的投加情况对总磷的去除效果并无显著影响,水中总磷含量均低于10 mg·L−1。但当时间为12 h时,总磷含量均增加,其中,未投加H2O2的增加程度更为显著。之后,总磷浓度降低,并趋于稳定,投加H2O2实验的48 h浸泡处理效果为0.64 mg·L−1,而未投加的为26.84 mg·L−1,此值较3 h处理效果更差。
分析认为,铁碳处理分为快速吸附和氧化反应2个阶段,初始的总磷含量下降主要是由于铁碳固体快速吸附造成的,故而是否投加H2O2对去除效果未表现出显著影响。随着反应时间的延长,铁碳表面发生微电解反应,产生氢气(或原子态氢[H])和亚铁离子,气体作用导致部分被吸附的磷脱附进入水中,这是导致水中总磷含量提升的原因。铁碳形成的电位差使得一部分次磷酸根、亚磷酸根在阳极发生氧化反应,被氧化为正磷酸根从水中去除,随着时间的延长,水中H+逐步被消耗,使得微电解反应逐渐被抑制,故未添加H2O2的体系中总磷含量稳定在较高浓度。体系中产生的亚铁离子可与H2O2共同作用,氧化水中的次磷酸根等物质为正磷酸盐。芬顿反应仅在投加H2O2的体系中存在,故导致了3 h之后2个体系的去除差异。
图6反映了废水中镍含量的变化情况与H2O2投加量和反应时间之间的关系。由图6可以看出,水中的镍被有效去除,故铁碳体系可有效实现破络过程。推测体系产生的新生态的氢和亚铁离子是破络过程的活性成分[16]。同时发现,去除率与时间成正比,投加H2O2对镍的去除效果影响不大,二者均在36 h时将水中镍含量降低至0.1 mg·L−1以下。3 h时,体系中pH较低且氧化还原反应(破络)尚未进行完全,这是导致Ni浓度较高的主要原因。随着微电解反应的进行,破络过程逐渐完成,镍离子被释放,体系pH逐步提高,在沉淀和吸附的共同作用下,使得废水中的镍得到去除。
在投加H2O2的条件下,铁碳处理工艺可基本实现化学镀废水同步除磷去镍的过程,但去除时间过长,且期间会产生大量铁泥和固体废物,造成二次污染。
-
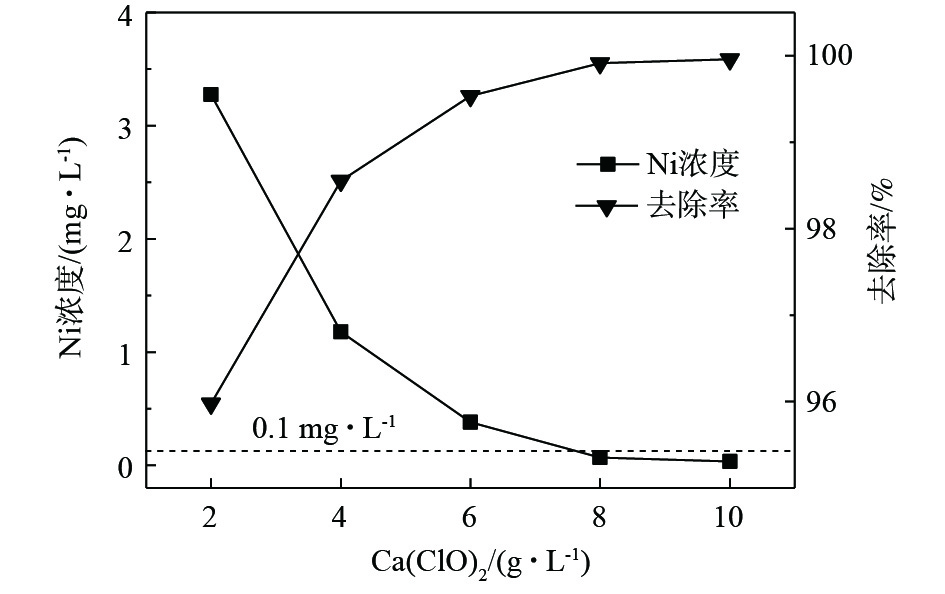
次氯酸根具有强氧化性,可破坏水中络合物的结构,从而释放络合态镍离子,使镍可进一步通过化学沉淀的方式去除。图7为反应温度为20 °C时,30 min次氯酸钙除镍效果同投加量的关系。可以看出,次氯酸钙除镍效果理想,可在常温(20 °C)条件下快速进行,提高Ca(ClO)2投加量对破络反应的发生以及沉淀反应的正向进行具有同步促进作用。当投加量为2 g·L−1时,对镍的去除率可达到95.97%。在投加量不少于8 g·L−1时,30 min即可使水中镍含量降低至0.1 mg·L−1以下。并且,当投加量不少于4 g·L−1时,反应过程中体系pH始终呈强碱性,反应结束无须调节体系pH,操作简单。但其对磷的去除效果受多种因素影响。
图8为次氯酸钙投加量为8 g·L−1时,温度与时间对总磷去除效果的影响。可以看出,磷的去除效果与时间呈正相关。在常温(20 °C)和加热的条件下,次氯酸钙对总磷均具有一定的去除效果,但随着温度的升高,去除速率相应提升,20 °C和80 °C的最高去除率可分别达到84.23%和99.97%,故加热更有利于反应的进行。可以看出,80 °C较60 °C的反应温度除磷效果更佳,但相差不大,且1 h时均可使水中磷含量低于0.5 mg·L−1。综合考虑经济因素与处理效果,认为次氯酸钙除磷的最佳加热温度为60 °C,最佳反应时间为1 h。
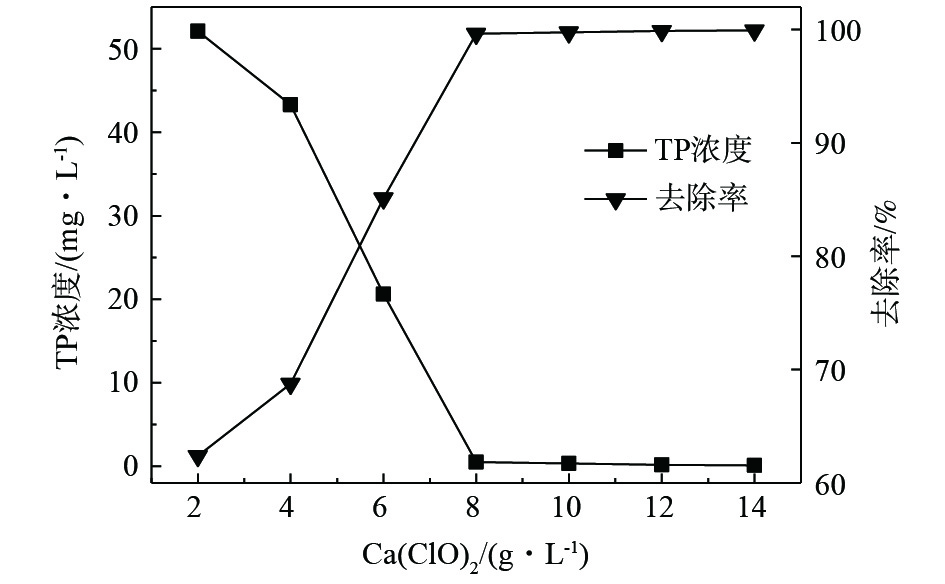
图9为反应温度为60 °C,反应时间为1 h时,次氯酸钙添加量与总磷去除效果的关系。在加热条件下,次氯酸钙的投加量与1 h总磷去除效果呈正相关,且除磷效果比较理想。增加Ca(ClO)2,可对反应起到促进作用,有助于废水中磷的完全去除。当投加量仅为2 mg·L−1时,即可去除水中62.39%的总磷;当投加量为8 g·L−1时,水中磷含量为0.49 mg·L−1,再次增加投药量,可进一步去除水中的磷,但从经济性考虑,可行性不高。因此,Ca(ClO)2的投加量为8 g·L−1时,可以实现对废液中磷和镍同步去除的效果。
-
表1为4种处理方法的去除效果的对比结果。
2.1. H2O2去除磷和镍的效果
2.2. 芬顿去除磷和镍的效果
2.3. 铁碳处理去除磷和镍的效果
2.4. 次氯酸钙去除效果
2.5. 去除效果比较
-
1) 在酸性条件下,H2O2可有效去除化学镀废水中的镍,但除磷效果不佳。添加铁盐的芬顿氧化过程可增强磷的去除效果,实现化学镀废水的同步除磷去镍过程,且总磷的去除为关键步骤。
2) 添加H2O2的铁碳处理过程可基本去除化学镀废水中的磷与镍,但反应时间过长,且易产生二次污染。
3) 次氯酸钙是一种理想的同步除磷去镍试剂,在投加量为8 g·L−1、反应温度为60 °C、反应时间为1 h的条件下,可达到同步除磷去镍的效果,且操作简单。



 下载:
下载: